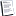
Niels Bohr studiando i risultati del lavoro di Rutheford riuscì a costruire una teoria che spiegava finalmente come si potessero avere questi salti di energia.
Il suo modello spiegò perfettamente le caratteristiche dell'atomo di idrogeno, il più semplice contenedo un protone, un neutrone ed un elettrone. Egli ipotizzò che ci fosse un nucleo composto da protoni e neutroni e che gli elettroni non potessero essere a qualunque distranza dal nucleo ma che le distanze fossero fisse. Questo modello (molto semplice) è ancora in uso in chimica.
Il protone è positivo e l'elettrone è negativo e questa attrazione fra i due permette all'elettrone di rimanere in un'orbita vincolata al nucleo. l'energia dell'elettrone però è fissa e quindi gli permette di stare solo in una orbita (distanza) definita. Dando energia all'elettrone egli ne prende la quantità necessaria per passare ad un'altra orbita (più lontana dal nucleo) saltando da una all'altra senza sostare fra le due. Questa situazione è però instabile e l'elettrone tende a ritornare all'orbita più vicina al nucleo restituendo lo stesso quanto di energia che aveva preso per allontanarsi. La distanza fra queste orbite (ben più di 2) è fissa per ogni tipo di atomo, quasi una impronta digitale. Ecco finalmente una teoria quantistica dell'atomo!
La teoria ed i disegni assomigliano proprio ad un sistema solare ed in effetti tutti provarono ad usare le conoscenze della fisica, così ben collaudate. Fino all'atomo di idrogeno funzionava pure ma poi con atomi più complessi iniziarono i guai....
(to be continued...)
__________________
Ogni tecnologia sufficientemente avanzata e' indistinguibile dalla magia.
Ultima modifica di ellebi111 : 24-04-2009 alle ore 02.55.32.
|